FDA geeft HistoSonics toestemming voor het allereerste Edison® Histotripsiesysteem
Bedrijf intensiveert lanceringsplannen van zijn platform met de benaming “Breakthrough Device”
MINNEAPOLIS–(BUSINESS WIRE)– HistoSonics®, (www.histosonics.com), de fabrikant van het Edison®-systeem en de nieuwe histotripsie therapieplatformen, kondigde vandaag de markttoelating aan van haar “Breakthrough” -platform via het De Novo Classificatieaanvraagproces van de Amerikaanse Food and Drug Administration (FDA), een rigoureuze route voor pre-market review voor medische hulpmiddelen zonder bestaand predicaat. De autorisatie voor het op de markt brengen maakt van Edison het eerste en enige histotripsieplatform dat in de Verenigde Staten beschikbaar is.
Dit persbericht bevat multimedia. Bekijk hier het volledige persbericht: https://www.businesswire.com/news/home/20231009564640/nl/
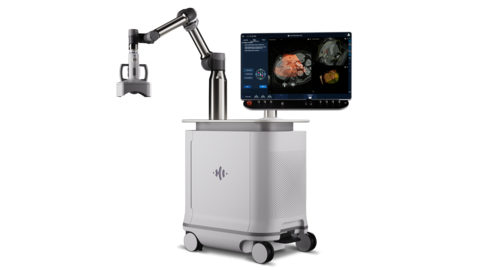
HistoSonics Edison Histotripsy System (Photo: Business Wire)
De goedkeuring van de FDA was gedeeltelijk gebaseerd op gegevens van de #HOPE4LIVER-onderzoeken in 13 onderzoekslocaties in de VS en Europa.
Deze bekendmaking is officieel geldend in de originele brontaal. Vertalingen zijn slechts als leeshulp bedoeld en moeten worden vergeleken met de tekst in de brontaal, die als enige rechtsgeldig is.
Bekijk het oorspronkelijke bericht op businesswire.com: https://www.businesswire.com/news/home/20231009564640/nl/
Contacts
Mediacontact:
Josh King
Vicevoorzitter Marketing
E-mail: Joshua.king@histosonics.com
Telefoon: 608.332.8124

