Cybin ontvangt FDA-aanduiding voor baanbrekende therapie voor zijn nieuwe psychedelische molecuul CYB003 en kondigt positieve duurzaamheidsgegevens over vier maanden aan voor depressieve stoornis
– Breakthrough Therapy Designation (‘BTD’) biedt een versneld beoordelingstraject, evenals verbeterde toegang tot richtlijnen van de Amerikaanse Food and Drug Administration (‘FDA’) over het ontwerp van onderzoeken, met het potentieel om de tijdlijnen voor de ontwikkeling van geneesmiddelen aanzienlijk te verkorten –
– Eerste bekende BTD toegekend door de FDA voor een aanvullende, op psychedelica gebaseerde therapie voor de behandeling van depressieve stoornis (‘MDD’) –
– Robuuste, aanhoudende en statistisch significante verbetering van de depressiesymptomen na vier maanden, waarbij 75% van de patiënten in remissie was van de depressie na twee doses (16 mg) –
– Indrukwekkende gemiddelde reductie van 22 punten op de Montgomery-Asberg Depression Rating Scale (“MADRS”)-score ten opzichte van de uitgangswaarde na vier maanden –
– Gegevens ondersteunen de voortgang naar een cruciale multinationale Fase 3-studie van CYB003 voor MDD medio 2024 –
– Het bereiken van mijlpalen versnelt en vermindert de risico’s van het CYB003-ontwikkelingsprogramma –
– Het bedrijf gaat vandaag om 08:30 uur ET een webcast hosten om programma-updates van CYB003 te bespreken –
Dit persbericht vormt een ‘aangewezen persbericht’ voor de doeleinden van de prospectussupplementen van Cybin, elk gedateerd 23 augustus 2023, bij het korte basisprospectus van 17 augustus 2023, zoals gewijzigd op 22 december 2023.
TORONTO–(BUSINESS WIRE)– Cybin Inc. (NYSE American:CYBN) (Cboe CA: CYBN) (‘Cybin’ of het ‘bedrijf’), een biofarmaceutisch bedrijf in de klinische fase dat zich inzet voor een revolutie in de geestelijke gezondheidszorg door nieuwe en innovatieve, op psychedelica gebaseerde behandelingsopties van de volgende generatie te ontwikkelen, heeft vandaag aangekondigd dat de FDA de BTD-aanduiding heeft toegekend aan CYB003, zijn eigen gedeutereerde psilocybine-analoog in ontwikkeling voor de aanvullende behandeling van MDD.
Dit persbericht bevat multimedia. Bekijk hier het volledige persbericht: https://www.businesswire.com/news/home/20240313061897/nl/
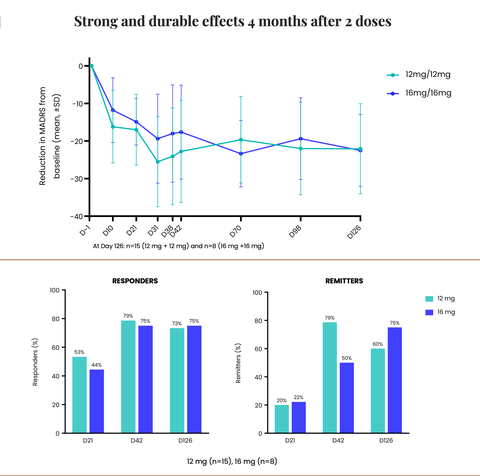
Strong and durable effects 4 months after 2 doses (Graphic: Business Wire)
Deze bekendmaking is officieel geldend in de originele brontaal. Vertalingen zijn slechts als leeshulp bedoeld en moeten worden vergeleken met de tekst in de brontaal, die als enige rechtsgeldig is.
Bekijk het oorspronkelijke bericht op businesswire.com: https://www.businesswire.com/news/home/20240313061897/nl/
Contacts
Beleggers en media:
Gabriel Fahel
Chief Legal Officer
Cybin Inc.
1-866-292-4601
irteam@cybin.com – of – media@cybin.com

